Icln
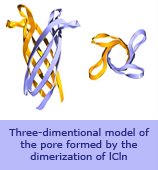
ICln è un canale ionico clonato da una linea epiteliale renale. Il modello strutturale prevede che l’unità costitutiva del poro sia formata da 8 filamenti antiparalleli disposti a b-barrel. Con tecniche di mutagenesi sito-specifica e ricostituzione in bilayer artificiali si sta determinando la funzione dei vari aminoacidi che circondano il poro. Queste sono le linee di ricerca:
- La regolazione del volume conseguente al rigonfiamento (Decremento Regolativo del Volume = DRV) è una caratteristica fondamentale di molte cellule. Una inibizione del DRV porta ad un arresto del ciclo cellulare e alterazioni delle funzioni cellulari. La comprensione dei meccanismi cellulari che permettono il DRV potrebbe portare alla individuazione di nuove sostanze capaci di controllare la crescita cellulare.
- In C. elegans è stata scoperta una variante della proteina ICln (IClnN2) con una stringa aggiuntiva, rispetto all’omologo di mammifero (ICln N1), di 20 amminoacidi. Dati di ricostituzione in membrane lipidiche artificiali e di overespressione in cellule di mammifero mostrano differenti caratteristiche biofisiche della corrente attraverso IClnN2. Si sta studiando la localizzazione delle due varianti ad splicing in C.elegans. Una loro diversa distribuzione potrebbe fornire indicazioni interessanti sul meccanismo di inattivazione del canale.
Nella nostra esperienza di laboratorio, oltre ad aver valutato l'attività di trasporto di glucosio, fluidi e cloro nel tratto del digiuno di intestino di ratto, abbiamo anche overespresso la nostra proteina Icln in E. coli e valutato l'attività di conduzione elettrica.
Qual'è stato il protocollo: abbiamo trasformato alcuni batteri di E. coli BL21 con un vettore plasmidico contenente nel cDna la sequenza per la proteina di interesse con il relativo promotore del fago T7 e la sequenza per la resistenza ad Amp. La proteina, o meglio, la sequenza nucletodica della proteina è stata clonata con l'aggiunta di una cosa di 6 Hys all'estremità N - terminale in modo da sfruttare l'interazion Hys - Nichel durante la cromatografia. Dopo aver incubato i batteri overnight su terreno solido con Amp abbiamo prelevato una colonia resistente ad Amp e lisata tramite centrifugazione. Il vantaggio di clonare in E. coli questa proteina è quello di permettere un'elevata espressione della stessa, l'assenza di splicing che comporterebbe una rimozione delle code di His e la possibilità di prelevare la proteina di interesse con facilità. Tenendo presente che Icln è una proteina citoplasmatica che, in seguito ad uno stimolo probabilmente dato da un incremento/decremento di volume cellulare, si trasferisce sulla membrana, in condizione isotoniche ed ipotoniche abbiamo provveduto alla lisi batterica e prelevato il surnatante (quindi non il pellet di membrana e annessi) contenente tutte le proteine citoplasmatiche del procariote. A questo punto abbiamo purificato la proteina tramite cromatografia, sfruttando la capacità dell'His di legarsi alla colonna di nichel e prodedendo con vari buffer di lisi. Quando, dopo circa 3 lavaggi, la proteina è parsa pure e il citoplasma completamente eluito, tramite un buffer di lisi competitivo con Icln abbiamo eluito anche la proteina e prelevato l'eluato per sottoporlo a SDS - page. Il risultato della quota proteica presa in esame tramite SDS ci ha permesso di determinare il PM della proteina e il suo grado di purezza, in relazione anche al campione mutante T477 privo di una serie di nucleotidi in posizione carbossi - terminale. Il rimanente campione è stato posto di membrana artificiale tramite la tecnica del tip - dip. La membrana artificiale viene costruita tramite una soluzione salina in cui sono sciolti lipidi cardiaci e una micropipetta da patch clamp contenente la stessa soluzione salina. Per interazione idrofobica, introducendo la pipetta nel bagno salino si crea un doppio strato lipido che può essere considerato una membrana in vitro (sfruttando le capacità di condensatore della membrana); a questo punto la proteina viene introdotta nel bagno e si nota che si dispone nella membrana. Tramite la tecnica del patch clamp si è valutata la corrente passante all'interno.
Gli aspetti positivi di questa esperienza di laboratorio, oltre alla manualità e nozioni acquisite, sono stati la possibilità di condurre in autonomia un'esperimento dall'inizio alla fine. Al contrario, ci sono alcuni nei, dati dal fatto che la proteina in vitro conduce potassio e si porta sulla membrana senza alcuno stimolo...
Questo laboratorio mi ha assorbito tantissimo tempo...ma è stata fantastica ed entusiasmante....!

1 commento:
TUTTE QUESTE COSE SONO DAVVERO GRANDIOSE... NON VEDO L'ORA DI FARE FISIO... MO' STUDIO ANATOMIA, PERO'...
:-9
Posta un commento